Hace poco mas de un mes encontraba un viernes en un descanso a media mañana en las VIII Jornadas Nacionales de Medicina del Deporte y me llamó una mujer que me preguntó si atendería su caso: “Rinosinusitis Crónica (CRS)”. Le respondí “honestamente nunca he tratado a nadie con CRS, pero puedo buscar en la literatura biomédica si existen estudios que permitan articular una intervención dietético-nutricional en la CRS”. Le comenté que me llamase el lunes para confirmarle o no si podría atenderla. Una búsqueda preliminar en Pubmed devolvió algunos estudios que me sorprendieron. Siempre he sido consciente de la transversalidad de la Nutrición Humana y Dietética (NhD), pero lo que jamás podría imaginar es que podría diseñarse una dieta personalizada en base a estudios que abordan distintas dianas. Su fin sería mejorar los síntomas y comorbilidades de la misma. Tengo curiosidad por ver como evoluciona. La mujer contactó de nuevo conmigo y le expuse brevemente el abordaje que realizaría.
Como la CRS no es una patología que se estudie en la facultad, pues a priori nadie imaginaría que se pudiese beneficiar de una intervención nutricional he estimado oportuno elaborar el siguiente contenido, con el fin de que pueda ser útil para los D-N y otros profesionales biosanitarios.
Indice
8-Enfermedades asociadas a CRS.
12-Métodos para caracterizar el fenotipo.
La CRS es una enfermedad crónica inflamatoria de la mucosa de los senos nasales y paranasales que resulta de una interacción disfuncional en la interface nariz-medioambiente caracterizada por una serie de signos y síntomas (1).
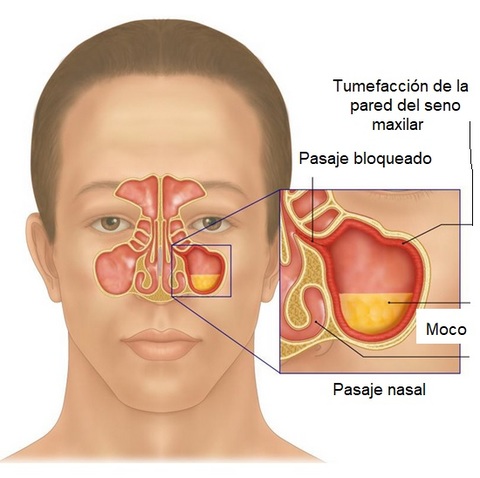
Los síntomas más habituales son: descarga nasal, disconfort facial, dolor en el maxilar, halitosis, rinorrea (goteo nasal), congestión nasal, letargia, fatiga… (2). Según la severidad de los síntomas los pacientes pueden ser categorizados dentro de un cuadro leve, moderado o intenso (1).
Presencia de dos o mas de los siguientes síntomas, donde el 1 siempre debe estar presente, durante los últimos 12 meses (1):
1-Congestión/obstrucción/bloqueo nasal o descarga nasal (goteo nasal anterior/posterior).
2-Dolor/presión facial.
3-Reducción del sentido del olfato.
Signos monitorizados mediante endoscopia de:
-Pólipos nasales y/o
-Descarga mucopurulenta principalmente del meato medio y/o
-Edema/obstrucción mucosa principalmente del meato medio.
Signos monitorizados mediante Tomografía Axial Computerizada (CT).
Cambios en la mucosa dentro del complejo osteomeatal y/o senos.
No existe una forma de CRS sino un espectro de CRS. La descripción fenotípica es clave para determinar la intervención más adecuada.
Se han descrito dos fenotipos en base a los hallazgos de la endoscopia (1,2):
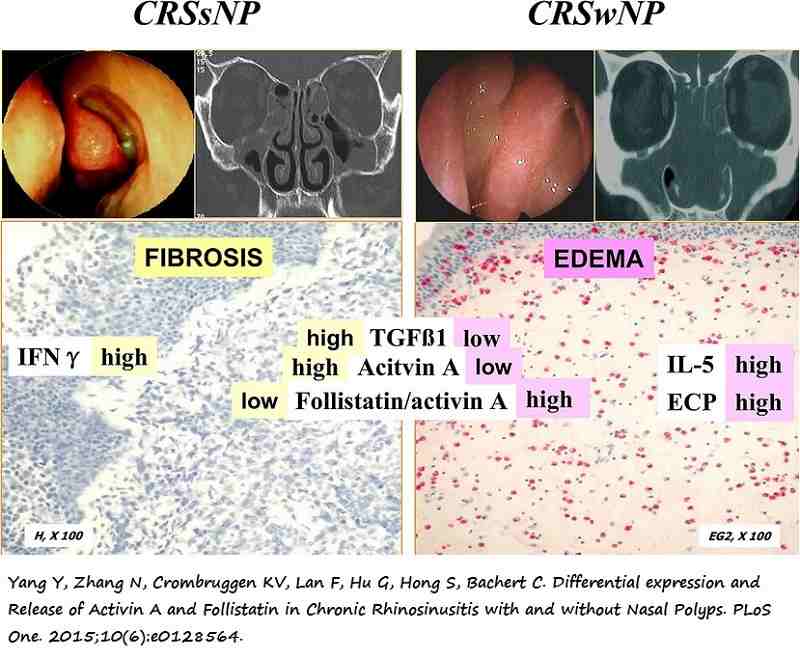
4.1-CRS sin pólipos nasales (CRSsNP): CRS definida conforme al punto 1 sin pólipos nasales en el meato medio.
4.2-CRS con pólipos nasales (CRSwNP): CRS definida conforme al punto 1 con presencia de pólipos nasales bilaterales, visibles mediante endoscopia, en el meato medio.
Aunque la definición es muy reduccionista resulta útil a nivel clínico, dado que la mayoría de los pólipos nasales en los países occidentales son de tipo eosinofílico y responden a corticoides esteroideos.

La RS es una de las enfermedades comunes más frecuentes en los países occidentales y muestra una variabilidad regional y temporal (3).
La RS fue la segunda enfermedad más frecuente en USA en el período 1990-92, según estadísticas del Center of Disease Control (CDC). Según los códigos de la Clasificación Internacional de Enfermedades (International Classification of Diseases=ICD), CRS corresponde a CD-9-CM Diagnosis Codes 473 y se define como la inflamación de los senos paranasales que se prolonga mas de 8 semanas (4). En más frecuente en el Sur que en el Norte de USA.
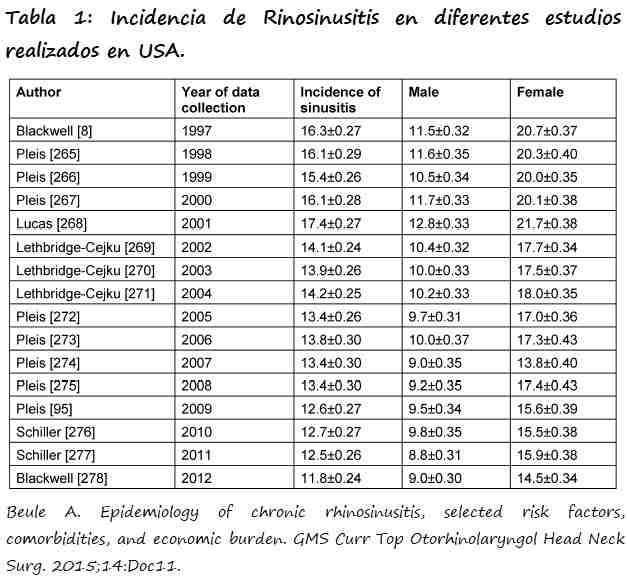
La incidencia de RS en USA ha descendido ligeramente en el intervalo 1997-2012, a pesar de los cambios metodológicos operados en el CDC/NIHS (reducción del tamaño muestral en un 13% y la estratificación por rangos de edad a partir de 2002) y la subestimación sistemática de la incidencia debido a la exclusión de los individuos que no respondían a la encuesta (3).
La reducción en la incidencia en USA también se atribuye a que hasta el 2014 no existía un seguro de salud público y la crisis económica que también alcanzó a dicha nación (3).
La incidencia es mayor en mujeres que en hombres. No se descarta que sea atribuible a que las mujeres estén más preocupadas por su salud y acudan con más frecuencia al médico.
Hastan D et al hallaron que la prevalencia de CRS en Europa en 2011, a partir de un estudio multicéntrico en 19 regiones europeas con una población entre 15-75 años fue de 10,9% (IC 95%: 6,9-27,1) (5). Las virtudes de este estudio es que los datos recabados para el diagnóstico presentaron una alta reproducibildidad al ser evaluados por profesionales biomédicos y no autoreportados como en estudios preliminares (3).
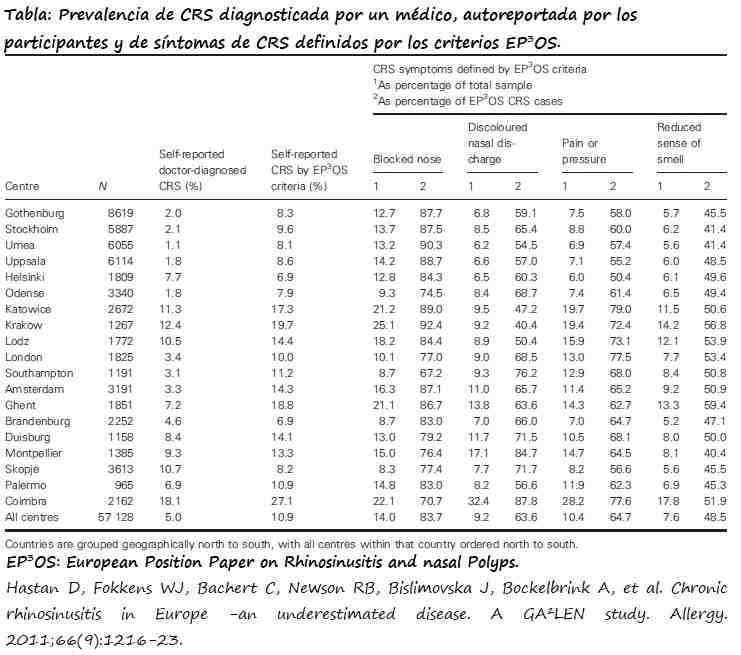
Se ha detectado una mayor prevalencia en regiones urbanas de Europa (3).
La prevalencia de CRS en USA en 2007, a partir de una base de datos del “Medical Expenditure Panel Survey” fue de un 4,9%±0,2% (6,7).
La CRS se asocia con ciertos genotipos, enfermedades comórbidas y factores medioambientales (8):
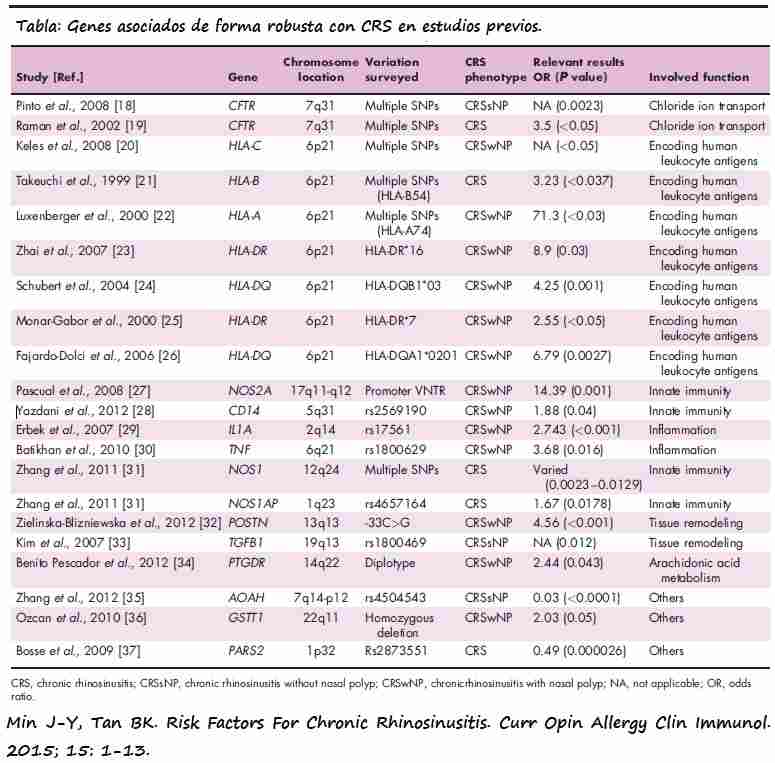
7.1-Genotipos asociados a CRS:
Se ha descrito multiples SNPs en los genes CFTR, NOS y HLA-A, HLA-B y HLA-C y genotipos HLA-DR16, HLA-DQB103… que se vinculan con un mayor riesgo de CRS.
7.2-Enfermedades comórbidas que afectan a la integridad y funcionamiento de las vías respiratorias:
La rinitis alérgica y no alérgica, el Reflujo Gastroesofágico (GER)/Reflujo Laringofaringeo, inmunodeficiencias primarias y secundarias, fibrosis quística y la disfunción mucociliar aumentan la predisposición a padecer CRS.
El estudio anteriormente mencionado de Hastan D et al halló una fuerte asociación entre la CRS y el asma a todas las edades y la correlación con el asma era mayor entre quienes presentaban CRS y rinitis alérgica. La CRS en ausencia de alergia se asociaba con un mayor riesgo de asma de debut tardío (5).
7.3-Factores medioambientales:
7.3.1-Exposición al tabaco.
El estudio GA2LEN puso de manifiesto que existe una asociación entre el CRS y el hábito tabáquico actual. Dicho estudio halló que los fumadores presentaban una aOR=1,9, 95% CI: 1,8–2,1 de presentar CRS y una aOR significativa pero más atenuada (1,3, 95% CI:1,2–1,4) entre los que llevaban más tiempo expuestos al tabaco (5). En una cohorte danesa de dicho estudio se halló que las mujeres y hombres fumadores presentaban 2,5 y 1,9 veces más riesgo (RR=2,5 y 1,9 respectivamente) de padecer CRS (9). Sin embargo el estudio third National Health and Nutrition Examination Survey (NHANES III) halló una relación más modesta entre el consumo de tabaco y el riesgo de CRS. Los sujetos con exposición más alta (40 cigarrillos/día) presentaban 1,2 veces más riesgo de padecer CRS (10). Ninguno de los estudios mencionados discriminaba entre fenotipos de CRS.
Los estudios que han indagado en la base fisiopatológica del humo del tabaco han encontrado mecanismos biológicamente plausibles que explicarían la asociación tabaco-CRS. El tabaco disminuye el aclaramiento mucociliar de la mucosa senonasal al alterar los mecanismos de transporte iónico, la ciliogénesis y suprimir la inmunidad innata a través de los Receptores Tipo Toll (TLRs), proteínas efectoras (e.g. defensinas) y componentes del sistema del complemento (8).
7.3.2-Calidad del aire en el interior y al aire libre.
A pesar de la creencia popular entre los pacientes y la población general de una relación inequívoca entre la contaminación y el riesgo de CRS, existen muy pocos estudios al respecto y pocos han utilizado los criterios diagnósticos de CRS.
Min YG et al no hallaron diferencias en la prevalencia de CRS entre poblaciones rurales y urbanas de una muestra de Corea del Sur (11).
Wolf C analizó la calidad del aire (niveles de Dióxido de Sulfuro -SO2-, Dióxido de Nitrógeno -NO2- y Partículas Suspendidas Totales -PST-), en una muestra de población alemana que demandaba tratamiento para la CRS en un hospital y no encontraron asociación entre la calidad del aire y CRS. Sin embargo cuando el análisis se restringía a aquellos distritos con niveles de contaminación levemente superiores a la media se halló una correlación positiva de pequeña magnitud. Los propios autores señalaron como debilidades del estudio la muestra de conveniencia, no se recogió información sobre la exposición individual al aire libre y no se intentó establecer una asociación entre los niveles de contaminación del aire y la severidad de la enfermedad (12). Bhattacharyya N analizó la relación entre la sinusitis autoreportada en USA y los niveles de SO2, NO2, Dióxido de Carbono (CO2) y PST y hallaron una correlación significativa pero débil entre la prevalencia de sinusitis y los parámetros de contaminación del aire (13).
Min J-Y & Tan BK señalan que sólo tienen constancia de un estudio en el fenotipo CRSwSP que haya evaluado la relación entre los espacios cerrados y los pólipos nasales (8). Kim J& Hanley JA concluyeron que existe una relación entre las estufas de madera y los pólipos nasales (14).
8-Enfermedades asociadas a CRS.
8.1-Enfermedades congénitas (e.g. fibrosis quística, Síndrome de Kartagener…) (2).
8.2-Enfermedades autoinmunes (Granulomatosis de Wegener) (2).
8.3-Anormalidad anatómicas (e.g. disfunción mucociliar) (2).
La CRS afecta a la calidad de vida del paciente, la productividad y su economía y en algunos casos de forma más severa que en otras enfermedades crónicas altamente prevalentes como la angina de pecho, Enfermedad Pulmonar Obstructiva Crónica (COPD) y el dolor de espalda (15).
La mayoría de los casos de CRS son idiopáticos. No se ha dilucidado completamente. Se han propuesto varias hipótesis que se clasifican según el origen del factor causal primario (16):
-Hipótesis etiológicas.
10.1-Exógeno: Aquella CRS que sería el resultado de un desencadenante ambiental (“trigger”) tales como toxinas, alérgenos y microorganismos que actúan sobre sujetos genéticamente susceptibles. Los factroes medioambientales que han demostrado una mayor contribución son los microorganismos (hongos y bacterias).
10.1.1-Fúngica.
10.1.2-Microbiana:
10.1.2.1-Microbioma.
10.1.2.2-Biofilms.
10.1.2.3-Superantigenos.
10.2-Endógeno: Aquella CRS que sería el resultado de una disfunción interna a nivel metabólico que actúa sobre sujetos genéticamente susceptibles.
10.2.1-Eicosanoides.
10.2.2-Barrera inmune.
Hipótesis:
10.1-Exógeno:
10.1.1-Fúngica.
Los primeros indicios se remontan a finales del siglo XX. Estudios in vitro y en seres humanos revelaron que los sujetos con CRS presentaban una hiperreactividad de las Células Mononucleares en sangre (BPMC) periférica a antígenos del hongo Alternaria, en relación a controles sanos, lo que se interpretó como una sensibilización inmunológica frente a antígenos fúngicos, independientemente de la atopia.
En un primer momento las proteínas fúngicas en aire inhalado son presentadas por las Células Presentadoras de Antígenos (APC) a los linfocitos T, promoviendo la secreción de citoquinas, que estimulan el reclutamiento de las PBMC, particularmente los eosinófilos a la mucosa nasal.
En un estadío posterior los eosinófilos responden de forma exacerbada frente al antígeno protéico fúngico, experimentando una degranulación y daño tisular colateral. Sin embargo la hipótesis fúngica fue descartada como causa primaria por las siguientes razones:
1-Los eosinófilos habitualmente no se consideran que formen parte del sistema inmune frente a los hongos in vivo. La activación y migración de los eosinófilos se considera una respuesta no específica.
2-Algunos intentos de replicar la hiperreactividad de las PBMC frente a antígenos fúngicos no lograron sus objetivos, por lo que los hallazgos originales no parecen ser universales.
3-Los Ensayos Clínicos Aleatorizados Doble Ciego (DBRCT) del uso de antifúngicos en el CRS frente a placebo no hallaron una mejora del curso de la enfermedad (e.g. anfotericina).
Aunque la hipótesis fúngica no representa la causa primaria del desarrollo de CRS, la colonización fúngica de la mucosa nasal se contempla como un modulador negativo de la enfermedad.
10.1.2-Microbiana.
La nariz es un nicho ecológico que alberga no sólo hongos sino también bacterias, pero su microbioma no ha sido caracterizado adecuadamente y son escasos los estudios que han utilizado la secuenciación de 16S.
La bacteria disbiótica de la mucosa nasal más asociada a CRS es Staphylococcus aureus, que es capaz de infiltrarse entre células epiteliales y macrófagos. En circunstancias normales, las bacterias, incluida Staphylococcus aureus evoca una respuesta inflamatoria Th17, que cuestiona el rol de las bacterias en la etiología de la CRS debido a que la respuesta inflamatoria hallada de forma más frecuente en los pacientes con casos más severos es Th2.
La teoría microbiana engloba tres subhipótesis:
10.1.2.1-Microbioma.
La disbiosis es una impronta de la CRS y otras enfermedades crónicas respiratorias. Los estudios que comparan el microbioma nasal de sujetos con CRS y controles encuentran diferencias en la diversidad y abundancia relativa de bacterias.
Cope et al identificaron al menos 4 endotipos en función del patrón de colonización microbiana nasal donde predomina una familia de bacterias patogénicas, en sujetos con CRS:
1-Predominio Streptococcaceae.
2-Predominio Pseudomonadaceae.
3-Predominio Corynebacteriaceae.
4-Predominio Staphylococcaceae.
Los pacientes con el predominio Corynebacteriaceae presentaban mayores niveles de expresión del gen Il-5 y mayor riesgo de pólipos nasales (17).
La existencia de una disbiosis en la nariz explicaría el perfil proinflamatorio y presencia de pólipos nasalaes hallados en CRSwNP. Además es probable que la microbiota difiera según las regiones de la nariz y senos.
La composición bacteriana de la nariz y el perfil inflamatorio difiere entre sujetos con CRS lo que dificulta los estudios actuales que tratan de establecer una relación causal entre el endotipo nasal y la CRS (17).
10.1.2.2-Biofilms.
Los biofilms son estructuras complejas altamente organizadas formados por comunidades de bacterias cubiertas por una matriz extracelular protectora integrada por polisacáridos, ácidos nucleicos y proteínas. Dicha matriz permite a las bacterias reducir su tasa metabólica cuando las condiciones medioambientales son desfavorables, protegiéndose frente a las defensas del huésped y ciertos antibióticos.
Múltiples especies bacterianas presentan la capacidad de formar biofilms como S. aureus, Pseudomonas aeruginosa, Streptoccoccus pneumonia, Haemophilus influenza y Moraxella catarrhalis, pero los biofilms de S. aureus son los que se asocian con la mayor severidad de la CRS. A diferencia de otras bacterias S. aureus tiene la capacidad de aumentar la vía Th2.
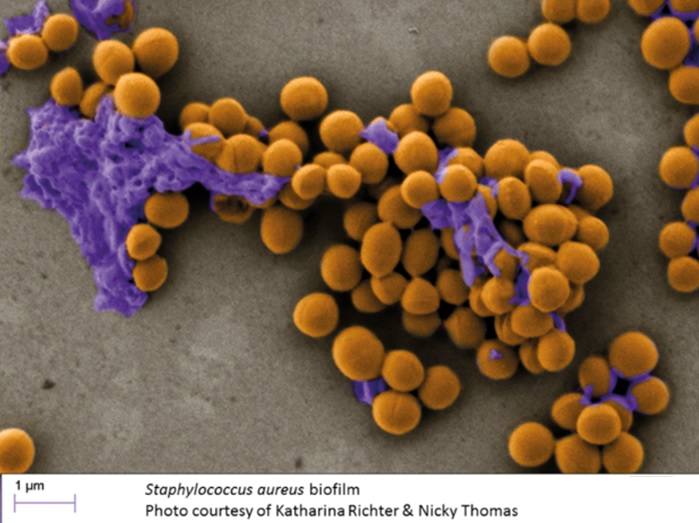
De todos modos la hipótesis de los biofilms no se ha articulado completamente y no existe una evidencia directa del rol de los biofilm en la CRS. Cualquier hipótesis de los biofilms desemboca en la hipótesis de los superantígenos.
10.1.2.3-Superantigenos.
Esta teoría postula que las exotoxinas Superantigénicas (SAGs) de Staphylococcus aureus amplifican la respuesta eosinofílica global por medio de una serie de mecanismos que estimulan la formación de pólipos. Se ha aislado S. aureus en los pólipos nasales de un gran porcentaje de pacientes con CRSwNP pero no en controles con CRSsNP. Las toxinas activan el 30% de la población de linfocitos T en comparación con el 0,001% en una respuesta inmune antígeno-específica en población normal. Se unen a los Receptores de Linfocitos T (TCR) y al Complejo de Histocompatibilidad de Clase II Antígeno Leucocitario Humano (HLA) de células presentadoras de antígenos. Por medio de este mecanismos las exotoxinas superantigénicas circunvalan los mecanismos de reconocimiento antigénico y estimulan la proliferación policlonal de los linfocitos T, promoviendo una secreción masiva de citoquinas, que en el caso de los pólipos nasales presenta un predominio de la respuesta Th2. También se ven afectadas otras células como los linfocitos B. Las respuestas mediadas por los linfocitos T y B en los pólipos son consideradas marcas de los SAGs. Se han hallado en la mitad de los pacientes con CRSwNP. Aunque hay pacientes con CRSsNP que son colonizados con Staphylococcus aureus, no presentan dicha marca metabólica. Por tanto no se sabe con certeza si los SAGs tienen un rol etiológico o sólo contribuyen a exacerbar la inflamación. En los pólipos eosinofílicos, los SAGs agravarían la respuesta Th2, dando lugar a un fenotipo más severo. Por esta razón la hipótesis de los SAGs se considera un modulador de la enfermedad que promueve la formación de pólipos más que un agente etiológico.
10.2-Endógeno:
10.2.1-Eicosanoides.
Los eicosanoides son un grupo de compuestos con actividad hormonal derivados del ácido araquidónico, altamente reactivos. Se ha postulado que ciertas alteraciones en el metabolismo de los eicosanoides (leucotrienos -LT-, prostaglandinas -PG-, prostaciclinas -PCI- y tromboxanos -TX-), asociadas tradicionalmente a la intolerancia a la aspirina, subyacerían bajo el CRSwNP. Se ha identificado un aumento de LT proinflamatorios y reducción de PG antiinflamatorios en pólipos tolerantes y no tolerantes a la aspirina. Sin embargo la investigación en esta área se ha visto mermada debido a que el cuerpo de evidencia es escaso, no se ha articulado una hipótesis formal y los inhibidores de LT no han resultado ser eficaces.
10.2.2-Barrera inmune.
La mucosa nasal está separada del medio ambiente por una barrera física formada por una capa mucociliar y uniones estrechas entre las células epiteliales, glándulas y células inmunes en contacto íntimo con aquella. Dichas células sintetizan y liberan una serie de proteínas con función antimicrobiana como defensinas, lisozimas, S100s, catelicidinas, lactoferrina, pentraxinas, PLUNC y colectinas. Dicha barrera semipermeable captura partículas extrañas en suspensión y evita su filtración hacia la mucosa.
Esta teoría sostiene que la CRS resulta de una disrupción en dicha barrera física mecánica e inmune articulada en forma de alteraciones en el flujo mucociliar y la formación de poros en la mucosa que permiten la entrada de Patrones Moleculares Asociados a Patógenos (PAMP), que conlleva un reclutamiento y activación de células efectoras del sistema inmune. La naturaleza y magnitud de esta respuesta inmune depende del fenotipo de CRS.
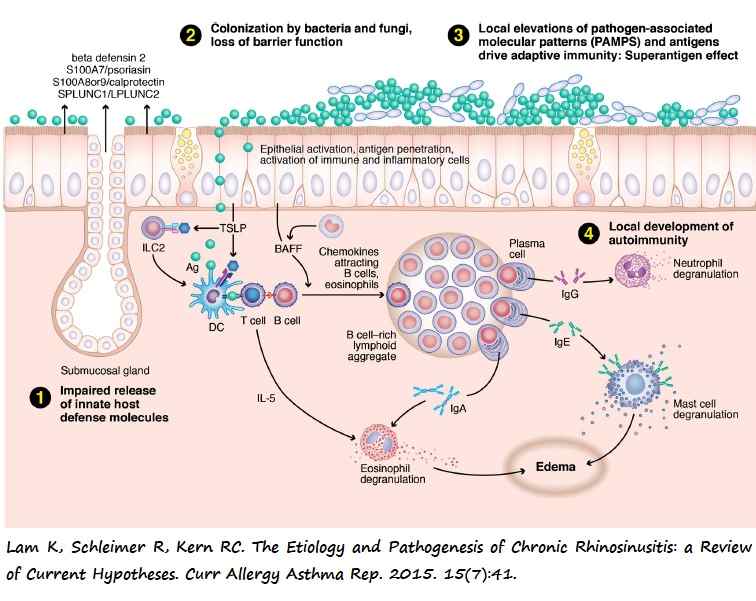
Varios estudios apuntan que la disfunción mucociliar está presente en ambos fenotipos de CRS pero la presencia de poros entre las células epiteliales es más prevalente en CRSwNP. Su distribución difiere según la región anatómica de la nariz y parece ser un reflejo de las diferencias en el microbioma nasal.
Sin embargo esta hipótesis no explica las diferencias en el perfil proinflamatorio observado en los distintos fenotipos de CRS.
De todos modos esta hipótesis es la que goza de un mayor reconocimiento entre la comunidad investigadora por su mayor solidez, amplitud y plausibilidad biológica. Se desconoce si la pérdida de integridad mecánica e inmune es el resultado de alteraciones genéticas en el huésped y/o modificaciones epigenéticas. Dado que la inflamación se circunscribe a la mucosa nasal, probablemente la CRS resulte de una disfunción en los genes que regulan la inflamación local y no sistémica.
Las principales guías de práctica clínica de CRS a nivel mundial son:
-The European Position Paper on Rhinosinusitis and Nasal Polyps (EPOS).
-British Society for Allergy and Clinical Immunology (BSACI)
-The Rhinosinusitis Initiative (RI)
-The Joint Task Force on Practice Parameters (JTFPP)
-Clinical Practice Guideline: Adult Sinusitis (CPG:AS)
No existe un acuerdo unánime sobre el manejo de la CRS.
La guía EPOS establece un abordaje escalonado según la severidad de los síntomas, pero no ha sido validado. Existe un vacío en la investigación de calidad en este ámbito (DBRCT) lo que limita la medicina traslacional (transferencia de los estudios in vitro, en modelos animales y seres humanos en una aplicación práctica aplicable en clínica) (Cho) Según Cho SH et al el principal problema es que existe una interpretación errónea entre el colectivo médico que considera la CRS como una enfermedad que precisa cirugía en lugar de una enfermedad médica que requiere una intervención integral.
12-Métodos para caracterizar el fenotipo de CRS.
Se debería realizar pruebas que permitiesen determinar el perfil inflamatorio, características histológicas, comorbilidades…
-Analítica de sangre: Permite determinar el tipo de infiltrado celular. (IgE, Eosinofília/neutrofília…).
-Patrón de expresión de citoquinas.
A modo ilustrativo cabe señalar que los caucásicos presentan pólipos caracterizados por altos niveles de eosinófilos, neutrófilos, mastocitos y linfocitos B; un patrón de expresión de citoquinas con predominio Th2 y un patrón de remodelado caracterizado por una disminución de colágeno, aumento de fibrina y edema. Por el contrario los pacientes con CF presentan pólipos con una mayor infiltración de neutrófilos y un patrón de expresión de citoquinas con predominio Th17 (16).
-Patrón de remodelado tisular.
-Técnicas de imagen:
-Endoscopia (rinoscópico). La rinolaringoscopia se debería realizar de forma rutinaria en pacientes en los que se sospecha una disfunción de las vías respiratorias, particularmente el CRS.
-CT.
-Cirugía: Muestra para biopsia de tejido de la mucosa nasal.
Identificar:
-Origen no infeccioso o infeccioso (microbiano/fúngico).
-Asociado o no a comorbilidades.
-Tipo de infiltrado.
-Desafío con AINES (e.g. aspirina) para discriminar la forma de CRSwNP con respuesta exacerbada a los mismos.
CRSwNP que presentan una respuesta exacerbada al consumo de AINES como la aspirina.
CRSsNP que no presentan una respuesta exacerbada al consumo de AINES como la aspirina.
El objetivo es lograr y mantener un control clínico de la CRS, que se define como la remisión completa de los síntomas o la presencia de síntomas no molestos en presencia de una mucosa nasal sana o prácticamente sana y la necesidad exclusiva de poca medicación (1).
Aunque la mayor parte de los sujetos logran un buen control de la CRS, un subgrupo se caracteriza por presentar una CRS difícil de tratar que se define como la persistencia de síntomas molestos a pesar del uso de dos corticoides nasales, dos ciclos cortos de antibióticos o corticoides sistémicos en el último año y cirugía (1).
El tratamiento se realiza en función del fenotipo y la severidad de los síntomas y se erige sobre los siguientes pilares:
Fenotipo CRSsNP
1-Estilo de vida: irrigación nasal con solución salina.
Existen evidencias preliminares que indican que la adición de hipoclorito sódico o xilitol a la solución salina utilizada para la irrigación nasal mejora el pronóstico, particularmente en sujetos refractarios al tratamiento con antibióticos postcirugía (1).
2-Fármacos: corticoides nasales y antibióticos.
La primera línea de actuación es la combinación de irrigación nasal con una solución salina y corticosteroides nasales.
La segunda vía de actuación, en aquellos sujetos en los que ha fallado la primera vía, es el uso de fármacos macrólidos, por su eficacia antiinflamatoria en enfermedades que afectan a las vías respiratorias bajas como la fibrosis quística y el asma (azitromicina, claritromicina…). Sin embargo su eficacia clínica en la CRS es objeto de controversia (1).
Fenotipo CRSsNP
1-Estilo de vida: irrigación nasal con solución salina.
2-Fármacos: corticoides nasales y antibióticos.
3-Cirugía.
Las exacerbaciones de la CRS deberían tratarse de igual modo que las Rinosinusitis Aguda (ARS).
Aunque la nutrición no forma parte del tratamiento estandarizado en la CRS, varios estudios sugieren de forma preliminar su posible eficacia en virtud de su capacidad para regular la inflamación y la microbiota de la mucosa nasal (18-23l.
1-La CRS es una enfermedad crónica inflamatoria de la mucosa de los senos nasales y paranasales que resulta de una interacción disfuncional en la interface nariz-medioambiente caracterizada por la congestión/obstrucción/bloqueo nasal y/o descarga nasal y/o dolor/presión facial que compromete la calidad de vida del paciente al interferir en su funcionamiento diario.
2-No existe un consenso entre las Guías de Práctica Clínica elaboradas por los principales organismos científicos, sobre la práctica clínica basada en la evidencia en la CRS.
3-El diagnóstico debe ser realizado por un médico, preferentemente un otorrinolaringólogo en base a la historia clínica, examen físico (rinolaringoscopia ), pruebas de laboratorio (e.g. IgE) y si fuesen procedente técnicas de imagen (e.g. CT). La rinolaringoscopia es un procedimiento simple y barato y se debería realizar de forma rutinaria en pacientes en los que se sospecha una disfunción de las vías respiratorias, particularmente el CRS. Esto permite describir con precisión los fenotipos particulares y personalizar el tratamiento.
4-El tratamiento depende del fenotipo (CRSwNP versus CRSsNP) y severidad de los síntomas y existen distintas líneas de intervención. La terapia en las formas más leves es la irrigación nasal con una solución salina y la administración de corticosteroides nasales (e.g. metilpredinolona). En caso de una exacerbación del cuadro se recurre a antiobóticos (e.g. macrólidos).
5-La eficacia de los corticosteroides nasales en la CRS es robusta.
6-La eficacia de los antibióticos en la CRS es objeto de controversia.
7-Se precisan estudios que permitan discriminar mediante pruebas de laboratorio, endoscopias y técnicas de imagen los distintos fenotipos de CRSwNP y CRSsNP, así como otras formas de sinusitis (e.g. rinosinusitis fúngica alérgica).
8-El conocimiento profundo del microbioma nasal permitirá estratificar los pacientes con CRS según su fenotipo particular que permitirá personalizar la intervención, con el fin último de lograr restaurar el microbioma hacia un fenotipo nasal sano.
9-Aunque la nutrición no forma parte del tratamiento estandarizado en la CRS, varios estudios sugieren su posible eficacia debido a la capacidad para modular el fenotipo de la mucosa nasal.
10-Se precisan estudios bien diseñados (RCT) que evalúen la posible eficacia de la nutrición en la CRS.
(1) Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012. A summary for otorhinolaryngologists. Rhinology. 2012;50(1):1-12.
(2) Cho SH, Bachert C, Lockey RF. Chronic Rhinosinusitis Phenotypes: An Approach to Better Medical Care for Chronic Rhinosinusitis. J Allergy Clin Immunol Pract. 2016;4(4):639-42.
(3) Beule A. Epidemiology of chronic rhinosinusitis, selected risk factors, comorbidities, and economic burden. GMS Curr Top Otorhinolaryngol Head Neck Surg. 2015;14:Doc11.
(4) Collins JG. Prevalence of selected chronic conditions: United States, 1990-1992. Vital Health Stat. 1997; 10;(194):1-89.
(5) Hastan D, Fokkens WJ, Bachert C, Newson RB, Bislimovska J, Bockelbrink A, et al. Chronic rhinosinusitis in Europe - an underestimated disease. A GA²LEN study. Allergy. 2011;66(9):1216-23.
(6) Bhattacharyya N. Incremental health care utilization and expenditures for chronic rhinosinusitis in the United States. Ann Otol Rhinol Laryngol. 2011;120(7):423-7.
(7) Bhattacharyya N. Functional limitations and workdays lost associated with chronic rhinosinusitis and allergic rhinitis. Am J Rhinol Allergy. 2012;26(2):120-2.
(8) Min J-Y, Tan BK. Risk Factors For Chronic Rhinosinusitis. Curr Opin Allergy Clin Immunol. 2015; 15: 1-13.
(9) Thilsing T, Rasmussen J, Lange B, et al. Chronic rhinosinusitis and occupational risk factors among 20- to 75-year-old Danes-A GA(2) LEN-based study. Am J Ind Med 2012; 55:1037–1043.
(10) Lieu JE, Feinstein AR. Confirmations and surprises in the association of tobacco use with sinusitis. Arch Otolaryngol Head Neck Surg 2000; 126: 940–46.
(11) Min YG, Jung HW, Kim HS, et al. Prevalence and risk factors of chronic sinusitis in Korea: results of a nationwide survey. Eur Arch Otorhinolaryngol 1996; 253:435–39.
(12) Wolf C. Urban air pollution and health: an ecological study of chronic rhinosinusitis in Cologne, Germany. Health Place 2002; 8:129–39.
(13) Bhattacharyya N. Air quality influences the prevalence of hay fever and sinusitis. Laryngoscope 2009; 119:429–33.
(14) Kim J, Hanley JA. The role of woodstoves in the etiology of nasal polyposis. Arch Otolaryngol Head Neck Surg 2002; 128:682–86.
(15) Gliklich RE, Metson R. The health impact of chronic sinusitis in patients seeking otolaryngologic care. Otolaryngol Head Neck Surg. 1995;113(1):104-9.
(16)Lam K, Schleimer R, Kern RC. The Etiology and Pathogenesis of Chronic Rhinosinusitis: a Review of Current Hypotheses. Curr Allergy Asthma Rep. 2015. 15(7):41.
(17) Cope EK, Goldberg AN, Pletcher SD, Lynch SV. Compositionally and functionally distinct sinus microbiota in chronic rhinosinusitis patients have immunological and clinically divergent consequences. Microbiome. 2017;5(1):53.
(18) Lee K, Pletcher SD, Lynch SV, Goldberg AN, Cope EK. Heterogeneity of Microbiota Dysbiosis in Chronic Rhinosinusitis: Potential Clinical Implications and Microbial Community Mechanisms Contributing to Sinonasal Inflammation. Front Cell Infect Microbiol. 2018;8:168.
(19) Balamohan SM, Tate AD, Dobson BC, Justice JM. Comparison between the Sinus and Gut Microbiome in Patients with Chronic Sinus Disease. Otolaryngol (Sunnyvale) 2018, Vol 8(3): 349.
(20) Lill C, Loader B, Seemann R, Zumtobel M, Brunner M, Heiduschka G, Thurnher D. Milk allergy is frequent in patients with chronic sinusitis and nasal polyposis. Am J Rhinol Allergy. 2011; 25(6):e221-4.
(21) Nayan S, Maby A, Endam LM, Desrosiers M. Dietary modifications for refractory chronic rhinosinusitis? Manipulating diet for the modulation of inflammation. Am J Rhinol Allergy. 2015;29(6):e170-4.
(22) Levy JM, Rudmik L, Peters AT, Wise SK, Rotenberg BW, Smith TL. Contemporary management of chronic rhinosinusitis with nasal polyposis in aspirin-exacerbated respiratory disease: an evidence-based review with recommendations. Int Forum Allergy Rhinol. 2016;6(12):1273-83.
(23) Mahdavinia M, Keshavarzian A, Tobin MC, Landay AL, Schleimer RP. A comprehensive review of the nasal microbiome in chronic rhinosinusitis (CRS). Clin Exp Allergy. 2016;46(1):21-41