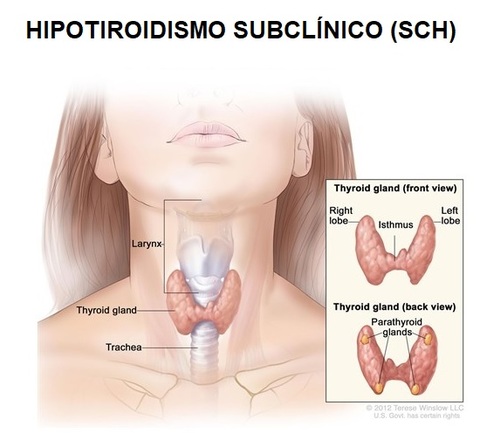
Me sorprende el número de pacientes (sobre todo mujeres) que acuden a consulta y refieren padecer hipotiroidismo subclínico. A pesar de ello, creo que sigue siendo una gran desconocida a pesar de su prevalencia, por lo que creo conveniente dedicarle un contenido.
Indice:
2-Endocrinología básica de la glándula tiroides.
2.3-El eje hipotálamo-hipofisiario-tiroideo.
2.4-Funciones de las hormonas tiroideas.
El Hipotiroidismo Subclínico (SCH) es una desorden endocrino caracterizado por un aumento de los niveles séricos de la Hormona Estimulante del Tiroides (TSH) y niveles normales de T4 libre (tiroxina) (1).
2-Endocrinología básica de la glándula tiroides (2).
El tiroides es una glándula con forma de mariposa situada en la zona anterior del cuello, justo por encima de la tráquea. Pesa alrededor de 15-20 gramos.
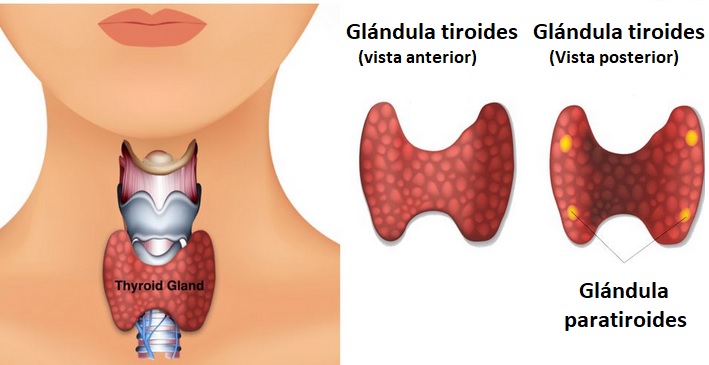
La glándula tiroides sintetiza y segrega dos hormonas: T3 (triiodotironina) y T4 (tetraioidotironina o tiroxina) al torrente circulatorio.
Un 20% de la T3 procede de la síntesis de la glándula tiroides y el 80% restante se produce a partir de la conversión intracelular de T4 a T3. Por este motivo T4 puede considerarse una pro-hormona.
T3 es 3-5 veces más potente que T4 y se considera la forma biológicamente activa.
En un sujeto sano se sintetizan y liberan 90-100 µg de T4 y 30-35 µg de T3/día.

2.3-El eje hipotálamo-hipofisiario-tiroideo.
TSH es sintetizada y liberada por las células tirotrofas de la hipófisis y actúa sobre la glándula tiroides estimulando la síntesis y secreción de T3 y T4.
TSH es sintetizada y segregada por estímulo de TRH (Hormona Liberadora de Tirotropina) hipotolámica sobre las células tirotrofas de la hipófisis.
T3 y T4, pero principalmente T3, autoregulan su síntesis mediante un mecanismo de retroalimentación negativa a nivel hipotalámico (TRH) e hipofisiario (TSH).
Cuando los niveles circulantes de T3 y T4 son altos, se inhibe la síntesis y secreción de TSH. Por el contrario cuando son bajos se estimula ésta.
Los valores medios de TSH en sujetos sanos con una función tiroidea normal es de 1.5 µU/ml según el estudio National Health and Nutrition Examination Survey (NHANES III study) (3)
2.4-Funciones de las hormonas tiroideas.
Intervienen en el crecimiento lineal, desarrollo de huesos, dientes y cerebro, metabolismo (aumentan el Gasto Energético en Reposo) y reproducción.
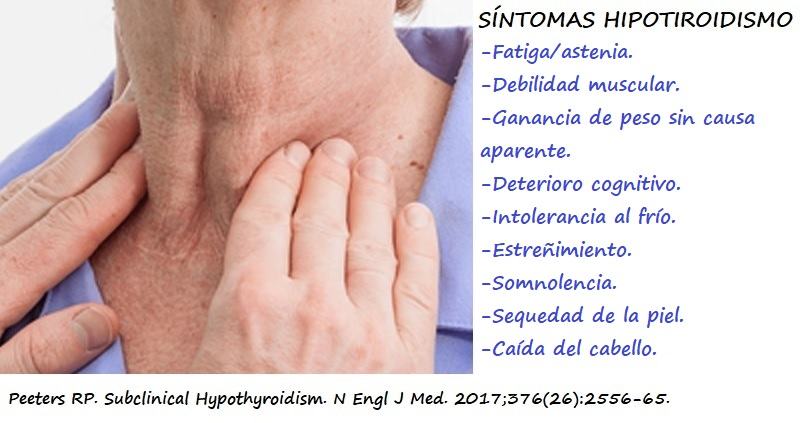
Los síntomas más habituales son fatiga, debilidad muscular, deterioro cognitivo y de memoria, ganancia de peso e intolerancia al frío (1).
La prevalencia mundial es de alrededor de un 0,4-16,9% dependiendo de la raza, sexo, edad y localización geográfica. La prevalencia es mayor en mujeres (0,9-16,9%), personas de edad avanzada (2,7-16,9%) y zonas con bajas ingestas de iodo. En personas eutiroideas (con valores de TSH normales) se observa un aumento de la misma con la edad por lo que la prevalencia de SCH en población anciana podría estar sobreestimada (4). Esto es congruente con las guías clínicas de la European Thyroid Association (ETA) que sugieren unos valores de referencia más elevados para personas con ≥70 años (4≤TSH<7 mUI/l) (5).
En España los últimos datos de prevalencia del SCH no tratado y tratado según el estudio Di@bet.es son de un 4.6% (CI: 4.0-5.2%) y 0.3% (CI 0.1-0.5%), respectivamente (6).
Cabe señalar que en la actualidad es difícil conocer con exactitud la prevalencia real de SCH debido a las diferentes definiciones de SCH que dependen del límite superior de los valores de referencia considerados. Los estudios de prevalencia futuros deberían contemplar que los valores de TSH difieren según la edad y la condición fisiopatológica (e.g. obesidad).
El HTS puede tener dos orígenes:
-Primario:
Resulta de una alteración en la glándula tiroides.
En el 99% de las ocasiones el SCH tiene un origen primario.
Las causas principales del HSC primario son:
-Tiroditis de Hashimoto (HT). En los países con una ingesta adecuada de iodo en la dieta (e.g. USA) la principal causa de SCH es la HT, que es una enfermedad de naturaleza autoinmune. La fisiopatología de la HT no ha clarificado suficientemente. Se ha postulado que la sobrestimulación de los linfocitos T CD4+ juegan un papel destacado. Investigaciones recientes apuntan a la participación simultánea de otras células como los lifocitos T colaboradores Th17 (CD4+IL-17+) o los linfocitos T reguladores (CD4+CD25+highFoxP3+) (7).
-Deficiencia en la ingesta de iodo. Propia de los países con una deficiencia endémica de iodo.
-Ablación de tiroides.
-Tratamiento incorrecto de la terapia con levotiroxina (L-T4).
-Secundario o central:
Consecuencia de una disfunción a nivel del hipotálamo o hipófisis.
Las causas habituales de SCH secundario son: (8)
-Lesiones cerebrales traumáticas.
-Farmacoterapia (e.g. beraxoteno, un ligando selectivo del receptor retinoide X, utilizado como segunda línea de tratamiento para los linfomas de células T cutáneos).
-Síndrome de Sheehan (infarto de la hipófisis secundaria a una hemorragia postparto).
-Neonatos concebidos por madres con Enfermedad de Graves mal controlada.
La dislipemia y la depresión son hallazgos frecuentes en el SCH.
El SCH se asocia con un mayor riesgo de varios factores de riesgo de CVD (dislipemia: aumento del colesterol total y el Colesterol de Baja Densidad -LDL-c-), Hipertensión Arterial (HBP), Síndrome Metabólico (MS), Espesor íntima-media carotideo (C-IMC) y ateroesclerosis, sobre todo en las formas severas (TSH≥10mUI/l) (9).
Rodondi N et al realizaron una revisión no sistemática a partir de 11 estudios prospectivos que aglutinaban 55287 participantes y un seguimiento entre 1972-2012 de 542494 personas-año. El riesgo de eventos de CHD fue examinado en 25977 participantes de 7 cohortes de los que se disponían todos los datos. Los autores consideraron SCH valores de 4,5≤TSH<19,9 mUI/l y valores normales de FT4. Un 6,2% de la muestra total presentaba SCH. En la siguiente tabla figura el Hazard Ratio (HR) de eventos de CHD, mortalidad por CHD y mortalidad total, según un modelo ajustado por sexo y edad. Cabe señalar que mientras el riesgo de CHD y mortalidad por CHD están aumentados en el SCH, no se halló un mayor riesgo de mortalidad total en éstos. Se hallaron resultados similares tras ajustar por los factores de riesgo clásicos de CVD y no existían diferencias estadísticamente significativas en el riesgo según edad, sexo y CVD preexistente (10).

Zhao T et al realizaron un meta-análisis a partir de estudios que evaluaban la relación entre el SCH y el riesgo de depresión. No se halló una relación entre ambos en la población total (Diferencia Media Estandarizada (SMD)=0,23; 95% CI: -0,03 a 0,48, P = 0,08, I2 = 73.6%). Sin embargo un análisis por subgrupos según edad, reveló que los pacientes más jóvenes (<60 años) con SCH presentaban mayor riesgo de depresión que los de más edad (≥60 años) (OR=3,8; 95% CI: 1,02 a 14,18, P = 0,047, I2 = 0,0%) (11).
El diagnóstico preciso y tratamiento del SCH supone un desafío en la práctica clínica para el endocrinólogo, pues no existe un consenso sobre el límite superior del rango de normalidad.
En la figura siguiente figuran los criterios diagnósticos de SCH en personas de <70 años, según la bioquímica sanguínea, sugeridas por la European Thyroid Association (ETA) (5).

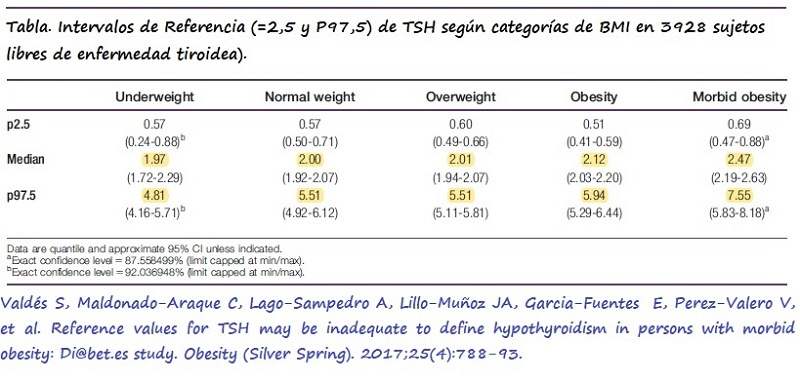
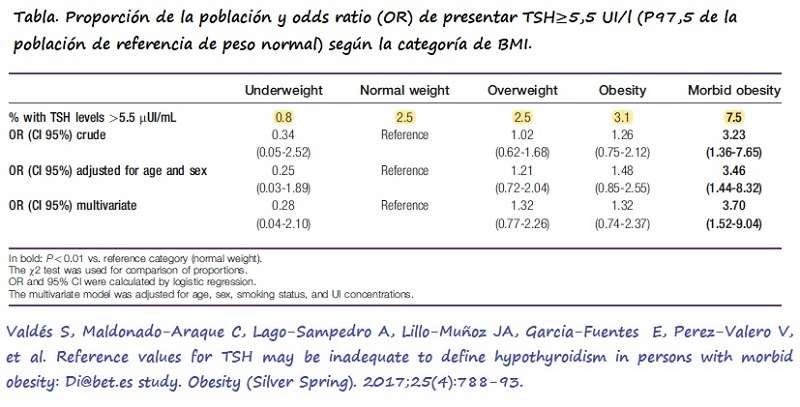
Recientemente Valdés S et al postularon que los valores de TSH anteriores no serían válidos en pacientes con obesidad. Los autores analizaron los niveles de TSH, FT4, así como de Anticuerpos Antiperoxidasa (TPO) en una muestra de 3928 individuos procedentes del estudio Di@bet.es, sin antecedentes de enfermedad tiroidea (TSH<10 mIU/l, sin consumo de fármacos que incrementasen TSH y FT4<50 IU/ml) en pacientes con distintas categorías de BMI y hallaron que TSH aumentaba conforme se incrementaba el BMI.
Los autores concluyeron que la proporción de individuos con obesidad mórbida y niveles elevados de TSH es tres veces mayor si se emplean valores de referencia de normalidad en población normopeso, en lugar de si se emplean sus propios valores de referencia (12).
Cabe señalar que la única figura profesional a quien compete el diagnóstico de un SCH es el médico con la especialidad de Endocrinología y Nutrición. Sin embargo el Dietista-Nutricionista (D-N) podría contribuir al despistaje de la enfermedad cuando un paciente acude a su consulta con una bioquímica sanguínea y presenta valores sugestivos de SCH, remitiéndolo al primero.
No siempre unos niveles de TSH elevados precisan tratamiento pues pueden resultar de un aumento transitorio de la misma por distintas situaciones fisiopatológicas (enfermedad no tiroidea, tiroiditis, consumo de ciertos fármacos…). Por este motivo todas las guías clínicas recomiendan repetir la analítica al cabo de 3-4 meses.
El tratamiento óptimo del hipotiroidismo no se ha dilucidado completamente.
Si los niveles de TSH son elevados pero transitorios y al cabo de 3-4 meses se vuelven a medir y salen dentro de parámetros normales, no se precisa tratamiento.
Si el paciente presenta una forma leve de SCH y no presenta síntomas ni comorbilidades, podría contemplarse que no recibiese tratamiento.
Si el paciente presenta una forma leve de SCH y no presenta síntomas pero sí comorbilidades, surge la cuestión de si debe ser tratado o no. El quid de la cuestión reside en si averiguar si el incremento de TSH aumenta el riesgo de padecer alguna enfermedad y el tratamiento con L-T4 es capaz de mejorar dichos desenlaces.
Abreu IM et al realizaron una revisión sistemática y meta-análisis de la literatura de Ensayos Clinicos Aleatorizados (RCT) que comparaban el efecto de la L-T4 y el placebo sobre los niveles de colesterol total y LDL-c. Los autores señalan que aunque se halló una disminución estadísticamente significativa (66,9 vs. 14%) pero modesta em términos de magnitud del efecto, sugieren tratar con L-T4 a los pacientes con SCH debido a que dicha disminución puede ser clínicamente significativa para reducir la incidencia de CHD (13).
Zhao T et al implementaron un meta-análisis a partir de 3 RCT que incluían 117 pacientes y evaluaban el efecto de la terapia con L-T4 sobre la reducción de la C-IMT. Los resultados del mismo indicaban que L-T4 reducía el desarrollo de C-IMT (diferencia de media ponderada (WMD)= -0.05 mm, 95% CI -0,08 a 0,01 mm; p=0,025). El análisis por subgrupos reveló que la terapia con L-T4 disminuía el C-IMT en pacientes de ambos sexos (WMD=-0,03 mm. 95% CI: -0,06 a -0,01 mm; p=0,145) y en mujeres (WMD -0,07 mm, 95% CI:-0,14 a -0,01; p=0,186). Los autores atribuyen dicha reducción a una mejora del colesterol total, triglicéridos, Presión Arterial Sistólica (SBP), Presión Arterial Diastólica (DBP), lipoproteína a (Lp(a)) y dilatación de la arterial medial mediada por flujo (14).
Sin embargo Zhao T et al en el meta-análisis anteriormente sobre SCH y riesgo de depresión citado no hallaron diferencias en el curso de la depresión entre los grupos que recibieron terapia con LT4 y el control en dichos pacientes (SMD=0,26; 95% CI: -0,09 a 0,62; P = 0,143, I2 = 52.9%) (11).
Nutrición:
Una dieta hipocalórica que contribuya a la pérdida de peso conlleva una disminución de TSH. A pesar de la percepción social que el SCH es causa de obesidad, el primero sería un mecanismo compensador que evitaría la expansión del tejido adiposo, por lo que la obesidad sería una causa y no una consecuencia del SCH (15).
El efecto de la nutrición el SCH es la gran desconocida en el ámbito biomédico. Estudios recientes sugieren la posible eficacia de ciertos nutrientes y compuestos bioactivos sobre el estrés oxidativo, inflamación, insulinresistencia e integridad del tirocito (16,17).
-Actividad física.
No tengo constancia de ninguna revisión ni narrativa ni sistemática sobre el impacto de la actividad física en el SCH. Recientemente Tanriverdi A et al evaluaron el nivel de actividad física utilizando el concepto PAL (Physical Activity Level) en una muestra de 32 mujeres recién diagnosticadas de SCH y 28 controles sanas. Se encontró que las mujeres con SCH tenían menores niveles de PAL (tiempo total de actividad física y número de pasos) , fuerza (menor fuerza prensil y de cuádriceps) y capacidad cardiorrespiratoria (invertían más tiempo en el test de la marcha de 6 minutos). Los autores atribuyen los hallazgos a los síntomas inherentes al SCH (fatiga, somnolencia…) (18).
-Farmacoterapia.
El fármaco utilizado es la L-T4. Los nombres comerciales más usuales son el eutirox y levotiroxina (19,20).

-La colaboración estrecha entre un médico endocrinólogo y un D-N es clave para un abordaje y manejo exitoso del SCH. Por tanto idealmente se requiere un abordaje multidisciplinar.
-Si presentas alguno de los signos o síntomas descritos en el punto, acude a tu médico general y exponle los mismos para que valore la idoneidad de medir TSH en una analítica y te derive al endocrino para un diagnóstico preciso.
-Si ya has sido diagnosticado de SCH previamente no olvides acudir a un control periódico con el endocrinólogo, cuya frecuencia dependerá de la estabilidad/desajuste de TSH y FT4. El endocrino es clave para que te prescriba la dosis oportuna de LT4 y realice un control periódico de la misma.
-En cualquiera de los dos escenarios anteriores no dudes en contemplar acudir a un Dietista-Nutricionista (D-N) para que te paute una dieta personalizada y valore la inclusión de suplementos nutricionales que puedan contribuir a la regulación del eje hipotálamo-hipofisiario-tiroideo.
-Si además padeces sobrepeso u obesidad acude a un Dietista-Nutricionista (D-N) para que te paute una dieta hipocalórica personalizada que redundará positivamente en la reducción de TSH.
-Si padeces SCT involúcrate en una actividad física tanto aeróbica como de fuerza.
-Si padeces SCH o estás interesado en el mismo filtra la información que leas en la web y evalúa críticamente la fuente.
(1) Peeters RP. Subclinical Hypothyroidism. N Engl J Med. 2017;376(26):2556-65.
(2) Pathophysiology and Diagnosis of Thyroid Disease. En: Consensus Study Report. Medicare Coverage of Routine Screening for Thyroid Dysfunction. Institute of Medicine (US) Committee on Medicare Coverage of Routine Thyroid Screening; Stone MB, Wallace RB, editors. Washington (DC): National Academies Press (US); 2003.
(3) Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, et al. Serum TSH, T(4), and thyroid antibodies in the United States opulation (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab. 2002;87(2):489-99.
(4) Hennessey JV, Espaillat R. Subclinical hypothyroidism: a historical view and shifting prevalence. Int J Clin Pract. 2015;69(7):771-82.
(5) Pearce SH, Brabant G, Duntas LH, et al. 2013 ETA guideline: management of subclinical hypothyroidism. Eur Thyroid J. 2013; 2: 215-28.
(6) Valdés S, Maldonado-Araque C, Lago-Sampedro A, Lillo JA, Garcia-Fuentes E, Perez-Valero V, et al. Population-Based National Prevalence of Thyroid Dysfunction in Spain and Associated Factors: Di@bet.es Study. Thyroid. 2017;27(2):156-66.
(7) Pyzik A, Grywalska E, Matyjaszek-Matuszek B, Roliński J. Immune disorders in Hashimoto's thyroiditis: what do we know so far? J Immunol Res. 2015;2015:979167.
(8) Yamada M, Mori M. Mechanisms related to the pathophysiology and management of central hypothyroidism. Nat Clin Pract Endocrinol Metab. 2008;4(12):683-94.
Loh HH, Lim LL, Yee A, Loh HS. Association between subclinical hypothyroidism and depression: an updated systematic review and meta-analysis. BMC Psychiatry. 2019;19(1):12.
(9) Delitala AP, Fanciulli G, Maioli M, Delitala G. Subclinical hypothyroidism, lipid metabolism and cardiovascular disease. Eur J Intern Med. 2017;38:17-24.
(10) Rodondi N, den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP, et al; Thyroid Studies Collaboration. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA. 2010;304(12):1365-74.
(11) Zhao T, Chen BM, Zhao XM, Shan ZY. Subclinical hypothyroidism and depression: a meta-analysis. Transl Psychiatry. 2018 ;8(1):239.
(12) Valdés S, Maldonado-Araque C, Lago-Sampedro A, Lillo-Muñoz JA, Garcia-Fuentes E, Perez-Valero V, et al. Reference values for TSH may be inadequate to define hypothyroidism in persons with morbid obesity: Di@bet.es study. Obesity (Silver Spring). 2017;25(4):788-93.
(13) Abreu IM, Lau E, de Sousa Pinto B, Carvalho D. Subclinical hypothyroidism: to treat or not to treat, that is the question! A systematic review with meta-analysis on lipid profile. Endocr Connect. 2017;6(3):188-99.
(14) Zhao T, Chen B, Zhou Y, Wang X, Zhang Y, Wang H, Shan Z. Effect of levothyroxine on the progression of carotid intima-media thickness in subclinical hypothyroidism patients: a meta-analysis. BMJ Open. 2017 Oct 22;7(10):e016053.
(15) Sanyal D, Raychaudhuri M. Hypothyroidism and obesity: An intriguing link. Indian J Endocrinol Metab. 2016;20(4):554-7.
(16) Rayman MP. Multiple nutritional factors and thyroid disease, with particular reference to autoimmune thyroid disease. Proc Nutr Soc. 2019;78(1):34-44.
(17) Hu S, Rayman MP. Multiple Nutritional Factors and the Risk of Hashimoto's Thyroiditis. Thyroid. 2017;27(5):597-610.
(18) Tanriverdi A, Ozcan Kahraman B, Ozsoy I, Bayraktar F, Ozgen Saydam B, Acar S, Ozpelit E, Akdeniz B, Savci S. Physical activity in women with subclinical hypothyroidism. J Endocrinol Invest. 2019;42(7):779-85.
(19) Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS, et al; American Thyroid Association Task Force on Thyroid Hormone Replacement. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 2014;24(12):1670-751.
(20) Guglielmi R, Frasoldati A, Zini M, Grimaldi F, Gharib H, Garber JR, Papini E. Italian Association of Clinical Endocrinologists Statement-Replacement Therapy for Primary Hypothyroidism: a Brief Guide for Clinical Practice. Endocr Pract. 2016;22(11):1319-26.