985 34 43 58

ÂżEs buena la soja para la salud? Hipogonadismo inducido por una dieta rica en alimentos derivados de la soja. Historia de un caso
DescripciĂłn de un caso clĂnico de un joven de 19 años con DMTI diagnosticado de hipogonadismo inducido por el consumo de una dieta muy rica en soja.
Probablemente te identifiques con esta imagen:
Acudes al supermercado y en la zona de bebidas vegetales, tomas un brick de leche de soja del lineal y lo incorporas en la cesta de la compra. Más adelante en la sección de refrigerados introduces el tofu y yogures de soja.
Al llegar a casa recoges las cosas, te pones ropa de deporte y vas al gimnasio. Al regresar tomas un batido de proteína y al leer el etiquetado reparas en que pone “extracto de proteína de soja al 90% “.
Quizás esta situación parezca un poco extrema, pero no dista mucho de la realidad de algunas personas. Pero tienes la certeza que la soja es un compendio de virtudes, así que porqué preocuparse. ¿Te has planteado alguna vez cual es tu consumo de soja al mes? ¿Tiene algún riesgo para la salud el consumo crónico y en cantidades elevadas de alimentos derivados de la soja?
Como en otros artículos se enumeran las conclusiones, para que aquellos que no deseen profundizar en el tema no se vean forzados a leer el artículo íntegramente.

Conclusiones
1-Siepmann T et al describen el caso de un joven de 19 años con DMTI (Diabetes Mellitus tipo I) que refiere síntomas de disfunción eréctil y pérdida de libido. El perfil hormonal en el momento del diagnóstico revela niveles de testosterona total y libre bajos y DHEA (DeHidroEpiAndrosterona) altos (1).
2-Los síntomas hallados tienen un correlato con los niveles hormonales (bajos de testosterona total y libre) y son compatibles con un diagnóstico de hipogonadismo.
3-La causa del hipogonadismo se atribuye a un hipofuncionamiento del eje hipotálamo-hipofisionario-testicular, inducido por el consumo de una cantidad elevada de productos con soja en el contexto de una dieta vegana. Se estimó la ingesta media de isoflavonas/día en 360 mg, 360 veces más que un europeo medio (2), 14 veces más que un inglés (3) y 7-14 veces mas que un asiático (4).

4-Existen mecanismos biológicamente plausibles del hallazgo observado: Las isoflavonas actúan como antagonistas del RE-α y/o inhiben 17-β-HSD (17-β-Hidroxi-Esteroide Deshidrogenasa y 3-β-HSD (3-β-Esteroide- Deshidrogenasa) y/o aumentan SHBG (1).
5-Mesina M et al realizaron un meta-análisis sobre el efecto del consumo de proteína de soja e isoflavonas y los efectos feminizantes en el varón y concluyeron que las isoflavonas a dosis muy altas no inducen efectos feminizantes en el varón. Por tanto parece que se trata de un caso clínico excepcional, que no ha sido reproducido en la literatura biomédica (5).
 6-Sin embargo no se puede concluir que no exista una relación entre isoflavonas-hipogonadismo. La eficacia clínica de las isoflavonas sería una función de la capacidad metabólica para transformar aquellas en equol, un metabolito con una mayor potencia estrogénica, debido a que amplifica su acción en virtud de su mayor afinidad por el RE, propiedades antiandrogénicas únicas y actividad antioxidante. No todos los individuos que consumen daidzeína producen equol. Sólo 1/3 a 1/2 de la población presentan esa capacidad metabólica. Se atribuye a diferencias en la microbiota intestinal. No se ha dilucidado aun que géneros y especies bacterianas estarían implicados (6).
6-Sin embargo no se puede concluir que no exista una relación entre isoflavonas-hipogonadismo. La eficacia clínica de las isoflavonas sería una función de la capacidad metabólica para transformar aquellas en equol, un metabolito con una mayor potencia estrogénica, debido a que amplifica su acción en virtud de su mayor afinidad por el RE, propiedades antiandrogénicas únicas y actividad antioxidante. No todos los individuos que consumen daidzeína producen equol. Sólo 1/3 a 1/2 de la población presentan esa capacidad metabólica. Se atribuye a diferencias en la microbiota intestinal. No se ha dilucidado aun que géneros y especies bacterianas estarían implicados (6).
7-Se precisan más estudios y mejor diseñados que arrojen luz sobre la posible relación entre el consumo de soja y alteraciones en los caracteres sexuales secundarios del varón (bajos niveles de testosterona, pérdida de líbido, disfunción eréctil, reducción cantidad y/o calidad de los espermatozoides…) (7).
8-Este caso clínico sólo pretende ilustrar como el consumo de un alimento sano, en exceso puede conllevar efectos indeseables sobre la salud.
9-Dado el aumento en el consumo de soja en los países occidentales sería recomendable que su etiquetado nutricional indicase el tipo y concentración de isoflavonas (7).
11-Aunque las bondades atribuidas a la soja la han encumbrado como un alimento aparentemente saludable, los resultados contradictorios de algunos ensayos clínicos cuestionan la validez de dichas alegaciones. Las diferencias pueden residir en el diseño metodológico deficiente de algunos estudios, particularmente en la falta de información y control sobre la naturaleza, cantidad y biodisponibilidad de las isoflavonas (7).
12-Se precisa una estandarización sobre el tipo, cantidad y biodisponibilidad de las isoflavonas empleadas en los ensayos clínicos.
13-A la expectativa de que nuevos estudios contribuyan a clarificar la relación consumo de soja e hipogonadismo, se recomienda un consumo moderado de soja mediante métodos tradicionales o mínimamente procesado, con objeto de lograr un efecto beneficioso modesto sobre la salud, al mismo tiempo que se minimizan sus posibles efectos adversos, como el riesgo de feminización en el varón (7).
Descripción del caso clínico
Motivo de consulta:
Paciente de 19 años con DMTI (Diabetes Mellitus Tipo I), que acude al médico y refiere una pérdida de libido y disfunción eréctil completa que se hizo manifiesta por primera vez 1 año antes (1).
Antecedentes personales:
El paciente refiere una vida sexual activa hasta entonces y se descarta trauma testicular, orquitis (inflamación testicular) o criptorquidia (testículos no descendidos), uso de fármacos hormonales, consumo de drogas, enfermedad psiquiátrica, enfermedad de transmisión sexual, cefalea, alteraciones de la visión y cambios en la masa muscular y la fuerza. Las dimensiones testiculares y el patrón de vello corporal eran normales (1).
Tratamiento:
El paciente utiliza los siguientes fármacos: análogo de la insulina Levemir (inyectable) (10-15U/día), NovoLog, atorvastatina (10mg/día) y ramipril (5 ml/día). La administración de estos dos últimos fármacos: atorvastatina, un agente hipocoloresterolemiante) y ramipril, un inhibidor de ECA (Enzima Convertidora de Angiotensina) tienen por objeto prevenir el riesgo cardiovascular asociado al tratamiento antidiabético (1).
Otros parámetros:
Evaluación de la composición corporal:
Su IMC (22 Kg/m2), % MG (12,5) y PA (120/80) estaban dentro de parámetros normales (1).

Evaluación del estado nutricional:
Una evaluación del estado nutricional puso de relieve que el paciente había comenzado una dieta vegeta pocos días antes de la aparición de los síntomas, en la que sobresalía la ingesta de alimentos derivados de la soja (leche de soja, galletas de soja, tofu, salsa de soja, habas de soja y edamame –vainas de soja inmaduras-), con una ingesta media de isoflavonas de 360mg/día durante 1 año. Antes del inicio de la dieta se había adherido a una dieta de la ADA (American Diabetes Association) de 2000 Kcal (1).
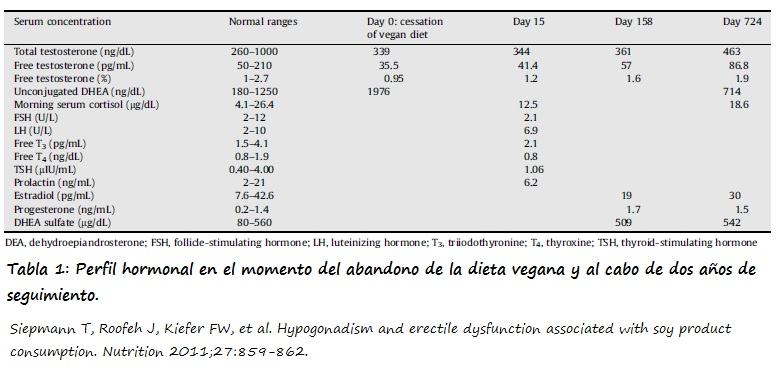
En la tabla 1 figura el perfil hormonal en el momento del cesación de la dieta, al cabo de 15, 158 y 724 días.
Indicaciones terapéuticas
Se insta al paciente a que abandone la dieta vegana, particularmente la ingesta de soja.
Evolución
El paciente refiere una mejora de los síntomas una vez que interrumpe la dieta y una normalización de la función sexual en el transcurso de los 12 primeros meses. La mejora de los síntomas cursa de forma paralela a un aumento de la testosterona total (TT) y libre (FT). Al cabo de 15 días de la interrupción de la dieta la TT se había normalizado (TT=344 ng/dl; normalidad=260-1000 ng/dl), mientras que la FT aun permanecía baja (41,4 pg/ml, siendo la normalidad: 50-210 pg/ml). La FT se normalizó al cabo de 158 días (57 pg/ml). La DHEA no conjugada se había normalizado al cabo de 724 días (714 ng/dl, normalidad: 180-1250 ng/dl) (1).
Observaciones con relevancia clínica.
Kemppainen BW et al administraron isoflavonas a ratas macho y evaluaron la respuesta a nivel del eje hipotalámo-hipofisiario-gonadal, postulando como mecanismos biológicamente plausibles del hipogonadismo observado (8):
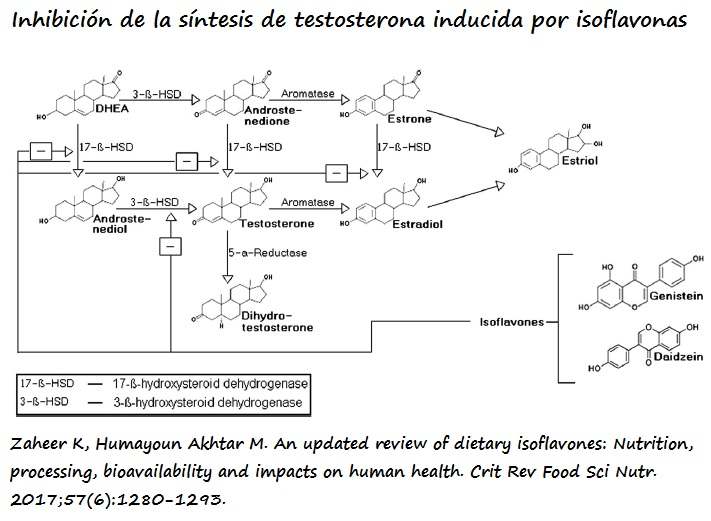
1-Las isoflavonas actúan como un antagonista de los RE-α expresados en las células de Leydig, inhibiendo la síntesis y secreción de testosterona.
2-Las isoflavonas inhiben las enzimas 17-β-HSD (17-β-Hidroxi-Esteroide Deshidrogenasa) y 3-β-HSD (3-β-Esteroide- Deshidrogenasa), que median en la conversión de DHEA en androstenediol y androstenediona respectivamente, dando lugar a altos niveles de DHEA.
3-Aumento de SHBG (Proteína Fijadora de Hormonas Sexuales). En un sujeto sano el 60% de la testosterona es transportada en sangre unida a SHBG forma robusta, 38% unida a albúmina de forma laxa y un 2% en forma libre (conocida como FT). SHBG es biológicamente inactiva, mientras que la BT (Testosterona Biodisponible) que resulta de la suma de las otras dos fracciones (libre y unida a albúmina) se considera biológicamente activa. El aumento de SHBG y unos valores de testosterona dentro de la normalidad son expresión de una disminución de BT y por ende de TT y/o unida a albúmina. La ausencia de valores de SHBG impide confirmar esta hipótesis.
Aunque ciertos fármacos reducen la testosterona como antifungicos (e.g. ketoconazol), antiparasitarios (e.g. metronidazol), psicofármacos (e.g. diazepam, antidepresivos tricíclicos, reserpina), antiepilépticos (e.g. fenitoína)…se descarta que los fármacos utilizados por el paciente (hipoglucemiantes, hipocolesterolemiantes e inhibidores de ECA) sean los responsables.
Por tanto la hipótesis que una alimentación rica en isoflavonas es la responsable del hipogonadismo es biológicamente plausible y no una simple especulación.
van Erp-Baart MA et al estimaron la ingesta media de isoflavonas en cuatro poblaciones europeas: UK, Irlanda, Holanda e Italia, cifrándose en menos de 1 mg/día (2). Estos valores difieren respecto a otros estudios como el EPIC.
Zamora-Ros R et al estimaron la ingesta de cinco tipos de fitoestrógenos (isoflavonas, lignanos, cumestanos, enterolignanos y equol) y sus fuentes alimentarias en 36037 sujetos de 35-74 años, distribuidos en 27 cohortes de 10 países europeos del estudio EPIC, a partir de un cuestionario de 24 horas administrado mediante un programa informático (EPIC-Soft). Se observó un gradiente de ingesta, con niveles mayores en el Norte e inferiores en el Sur de Europa. La ingesta más alta se halló en UK (24.9 mg/día en hombres y 21.1 mg/día en mujeres), mientras que las más bajas se alcanzaron en Grecia (1.3 mg/día en hombres) y en España-Granada (1.0 mg/day) en mujeres. En UK el principal tipo de fitoestrógenos fueron las isoflavonas y su fuente alimentaria la soja y en el resto de los lignanos (3).
Los niveles de ingesta de isoflavonas en Europa son en términos generales sustancialmente más bajos que los estimados en población asiática, en los que los alimentos derivados de la soja tienen una mayor omnipresencia. Messina M et al. estimaron la ingesta media de isoflavonas en 4 países asiáticos: Japón, China, Hong-Kong y Singapur. En este caso los autores midieron los niveles de proteína de soja como un subrogado de isoflavonas. Los japoneses adultos de más edad consumen 25-50 mg of isoflavonas/día (expresadas como equivalentes de aglicona), que equivalen a 6-11 g proteína soja/día. La ingesta en Hong Kong y Singapur es inferior a la de Japón, mientras que en China existen diferencias regionales. Un ≤10% de la población asiática consume unos 100mg isoflavonas/día, equivalente a 25 g proteína de soja/día (4).
Se consideran niveles fisiológicamente activos, valores de de 60-100 mg/día.
Por tanto el joven de 19 años del caso clínico descrito estaba ingiriendo 360 veces más mg de isoflavonas/día que un ciudadano europeo medio y entre 7-14 veces más mg de isoflavonas que un japonés adulto de edad avanzada medio.
Mesina M et al realizaron un meta-análisis sobre el efecto del consumo de proteína de soja e isoflavonas y los efectos feminizantes en el varón y concluyeron que las isoflavonas a dosis muy altas no inducen efectos feminizantes en el varón. Por tanto parece que se trata de un caso aislado, que no ha sido reproducido en la literatura biomédica. Sin embargo no se puede concluir que no exista una relación entre isoflavonas-hipogonadismo. La eficacia clínica de las isoflavonas sería una función de la capacidad metabólica para transformar aquellas en equol, un metabolito con una mayor potencia estrogénica, debido a que amplifica su acción en virtud de su mayor afinidad por el RE, propiedades antiandrogénicas únicas y actividad antioxidante. No todos los individuos que consumen daidzeína producen equol. Sólo 1/3 a ½ de la población presentan esa capacidad metabólica. Se atribuye a diferencias en la microbiota intestinal. No se ha dilucidado aun que géneros y especies bacterianas estarían implicados (6).
El hecho de que no existan más casos clínicos como el de Siepmann T puede ser consecuencia de diferencias interindividuales (salud/enfermedad, factores nutrigenéticos, epigenéticos, variaciones en la microbiota intestinal, que determinan una respuesta variable en la bioconversión de isoflavonas en equol…).
Se precisa estudios bien diseñados tanto en nutrición básica (efectos de las isoflavonas sobre el eje hipotalamo-hipofisiario-gonadal en modelos animales) como aplicada (estimación de la ingesta de isoflavonas en poblaciones, casos clínicos como el descrito en este post, ensayos clínicos sobre isoflavonas-salud…).
Se requiere una estandarización sobre el tipo, cantidad y biodisponibilidad de las isoflavonas empleadas en los ensayos clínicos.
Mientras tanto, se recomienda un consumo moderado de soja mediante métodos tradicionales o mínimamente procesado, con objeto de lograr un efecto beneficioso modesto sobre la salud, al mismo tiempo que se minimizan sus posibles efectos adversos, como el riesgo de feminización en el varón (7).
Bibliografía
1. Siepmann T, Roofeh J, Kiefer FW, et al. Hypogonadism and erectile dysfunction associated with soy product consumption. Nutrition 2011;27:859-862.
2. van Erp-Baart MA, Brants HA, Kiely M, Mulligan A, Turrini A, Sermoneta C, Kilkkinen A, Valsta LM. Isoflavone intake in four different European countries: the VENUS approach. Br J Nutr. 2003;89 Suppl 1:S25-30.
3. Zamora-Ros R, Knaze V, Luján-Barroso L, Kuhnle GG, Mulligan AA, Touillaud M, et al. Dietary intakes and food sources of phytoestrogens in the European Prospective Investigation into Cancer and Nutrition (EPIC) 24-hour dietary recall cohort. Eur J Clin Nutr. 2012;66(8):932-41.
4. Messina M, Nagata C, Wu AH. Estimated Asian adult soy protein and isoflavone intakes. Nutr Cancer. 2006;55(1):1-12. Sherrill JD, Sparks M, Dennis J, Mansour M,
5. Messina M. Soybean isoflavone exposure does not have feminizing effects on men: a critical examination of the clinical evidence. Fertil Steril 2010;93:2095–104.
6. Yuan JP, Wang JH, Liu X. Metabolism of dietary soy isoflavones to equol by human intestinal microflora--implications for health. Mol Nutr Food Res. 2007;51(7):765-81.
7. Zaheer K, Humayoun Akhtar M. An updated review of dietary isoflavones: Nutrition, processing, bioavailability and impacts on human health. Crit Rev Food Sci Nutr. 2017;57(6):1280-1293.
8. Kemppainen BW, Bartol FF, et al.Developmental exposures of male rats to soy isoflavones impact Leydig cell differentiation. Biol Reprod 2010;83:488–501.

